Вакцина против клещевого энцефалита (КЭ) показывает мономодальное распределение размеров частиц в нижнем микрометрическом диапазоне, что соответствует ожидаемому размеру адъюванта на основе соли алюминия. Вакцина против гриппа на основе клеток, напротив, содержит как отдельные вирусы (примерно 30 нм), так и более крупные агрегаты (примерно 250 нм). Измерения дзета-потенциала показывают, что обе вакцины состоят из слабоанионных частиц. Интересно, что моделируемые нарушения холодовой цепи (тепловая обработка, замораживание-оттаивание) вызывают значительные изменения в распределении размеров частиц обеих вакцин.
1 Введение
Вакцины часто являются единственным рубежом защиты от вирусных инфекций, поскольку диапазон доступных в настоящее время противовирусных препаратов и эффективность лечения ограничены. Иначе обстоит дело с бактериальными инфекциями, когда антибиотики являются эффективным терапевтическим вмешательством.
Противовирусные вакцины могут состоять из живых возбудителей с ослабленной вирулентностью, которые вызывают у реципиента вялотекущую инфекцию. Хотя эта стратегия способна очень точно имитировать инфекцию, вызванную патогеном, и обычно вызывает очень устойчивый иммунный ответ, она может вызвать серьезные побочные эффекты у лиц с ослабленным иммунитетом.
Таким образом, большинство противовирусных вакцин в настоящее время производятся в формуляциях, не обладающих потенциалом репликации в организме реципиента. Они варьируются от химически инактивированных целых или расщепленных вирусов до рекомбинантных белков или вирусоподобных частиц, полученных методами генной инженерии. Хотя такие вакцины характеризуются лучшим профилем безопасности, они также имеют тенденцию вызывать более слабые иммунные ответы, чем их ослабленные живые аналоги. Следовательно, многие из них вводятся вместе с так называемыми адъювантами вакцины, которые увеличивают эффективность и продолжительность иммунного ответа.
Самым давним и все еще наиболее популярным таким адъювантом является соль алюминия (например, гидроксид или гидроксифосфат). Считается, что его иммуностимулирующие свойства связаны как с его способностью адсорбировать и удерживать антигены в течение длительного времени в месте инъекции, так и со способностью активировать локальное высвобождение провоспалительных медиаторов (1).
На иммуногенность вакцины значительное влияние оказывает размер её частиц. Вирусы, за некоторыми исключениями, представляют собой наночастицы размером от 15 до 300 нм. После инъекции частицы в этом диапазоне размеров эффективно захватываются дендритными клетками - классом иммунных клеток, обладающих уникальной способностью индуцировать иммунитет, опосредованный как антителами, так и клетками-киллерами (2). Напротив, частицы в микрометровом диапазоне размеров, например, частицы солей алюминия (1), поглощаются преимущественно моноцитами и макрофагами, вызывающими в основном опосредованный антителами иммунный ответ.
Принимая во внимание, что распределение различных классов иммунных клеток в организме сильно тканеспецифично, размер частиц вакцины должен быть адаптирован:
- Основываясь на типе иммунного ответа, необходимого для борьбы с патогеном
или
- В зависимости от пути доставки вакцины.
Динамическое рассеяние света (ДРС) - это быстрый и неинвазивный метод измерения, который выявляет распределение частиц по размерам в диапазоне от долей нанометра до нескольких микрометров, что делает ДРС предпочтительным методом контроля качества противовирусных вакцин (3).
В данном отчете показана способность Litesizer определять размер частиц двух противовирусных вакцин: вакцины против клещевого энцефалита (КЭ) с адъювантом в виде солей алюминия и инактивированной сплит-вакцины против гриппа без адъюванта. Были смоделированы нарушения холодовой цепи с целью сравнения образцов, хранившихся в оптимальных условиях с образцами, прошедшими термообработку или подвергнутыми циклу замораживания-оттаивания.
Кроме того, для оценки дзета-потенциала частиц вакцины были проведены измерения методом ЭРС, что обеспечило дополнительные сведения о стабильности препаратов.
2 Экспериментальная часть
2.1 Выбор образцов
В аптеке были приобретены две противовирусные вакцины:
- Вакцина против клещевого энцефалита (FSME-Immun®, Pfizer, Австрия)
Инактивированная вакцина на основе штамма клещевого энцефалита Neudörfl. Вирус реплицируется в фибробластах куриного эмбриона и инактивируется формальдегидом. Гидроксид алюминия используется в качестве адъюванта, а сывороточный альбумин человека - в качестве стабилизатора. Одна доза состоит из 2,4 мкг вирусного антигена в 0,5 мл разбавителя (4).
- Вакцина против вируса гриппа (Flucelvax®, Seqirus, USA)
Четырехвалентная вакцина против гриппа, содержащая 2 штамма вирусов гриппа A и 2 штамма вирусов гриппа B, в соответствии с рекомендациями ВОЗ на сезон гриппа 2019-2020 гг в северном полушарии. Вирусы реплицируются в непрерывной клеточной линии MDCK, инактивированы β-пропиолактоном, разрушены детергентом и очищены. Одна доза рассчитана на содержание 15 мкг вирусного гемагглютинина (НА) от каждого вирусного штамма или 60 мкг общей НА в 0,5 мл (5).
2.2 Подготовка образцов
Перед обработкой вакцины хранили в исходном состоянии при +4 °C в соответствии с рекомендациями производителя. Затем каждый образец был разделен на 3 части в стерильных микропробирках, которые хранили следующим образом:
- Один образец продолжили хранить при оптимальной температуре +4°C («необработанный» образец);
- Другой выдержали в сухожаровом шкафу при 50°C в течение 24 часов («перегретый» образец);
- Третий заморозили при температуре -18°C в течение 24 часов, после чего разморозили при температуре +4°C («заморожено-размороженный» образец).
Все три образца контролировали параллельно спустя 24 – 28 часов после вскрытия оригинальной упаковки.
2.3 Измерения ДРС
Для анализа методом ДРС образцы вакцины против клещевого энцефалита разводили в стерильном физиологическом растворе (0,9% NaCl) в 10 раз. Образцы вакцины против гриппа разбавляли в 5 раз стерильным физиологическим раствором. Данные разведения были признаны оптимальными для измерений ДРС в предварительном эксперименте (данные не приводятся).
Измерения проводились на приборе Anton Paar Litesizer 500. Для проведения эксперимента применялись кварцевые кюветы благодаря их превосходными оптическими качествами и пониженной адсорбцией белка по сравнению с одноразовыми (полистирольными) кюветами.
Измерения проводили при 25°C, под углом 175° (режим обратного рассеяния) и с использованием ручной настройки продолжительности измерения (12 сканирований, по 10 секунд на цикл). Затенение оптического фильтра и положение фокуса выбирались прибором автоматически.
Серии состояли минимум из 5 и максимум из 8 последовательных измерений. Результаты были усреднены по всему измерению. Статистическая значимость определялась при помощи двухвыборочного t-критерия (случай неравных дисперсий). Различия между наборами данных считались значимыми, когда возвращаемое р-значение составляло <0,05.
2.4 Измерения ЭРС
Образцы анализировались в исходной неразбавленном виде с использованием Univette и адаптера малого объема (объем образца: 50 мкл).
Измерения дзета-потенциала выполнялись на приборе Litesizer 500 при 25°C и с использованием режима «Белок», который обеспечивает небольшие перерывы между измерениями и, следовательно, ограничивает джоулево нагревание. Напряжение автоматически устанавливалось прибором. Качество измерений настраивали в ручном режим, с установкой по 200 сканирований на измерение.
Серии состояли из 5 последовательных измерений.
3 Обсуждение результатов
3.1 Измерение размера частиц образцов вакцины против клещевого энцефалита
Как показано на рисунке 1, взвешенное по интенсивности распределение частиц по размерам должным образом хранившейся вакцины против клещевого энцефалита (КЭ) «необработанный» образец, зеленая кривая) имеет единственный пик, достигающий максимума между 2 и 3 мкм, что соответствует известному размеру частиц коммерческого гидроксида алюминия, используемого в качестве адъюванта и находящегося в нижнем микрометровом диапазоне размера частиц (1).
Кроме того, гранулометрический состав обеих усредненных кривых (рис. 1) и всех отдельных измерений (не показан) полностью лишен пиков в диапазоне размеров от 0 до 1000 нм. Это указывает на то, что вирусные частицы не обнаруживаются как свободно движущиеся объекты и, вероятно, в подавляющем большинстве адсорбируются на частицах адъюванта.
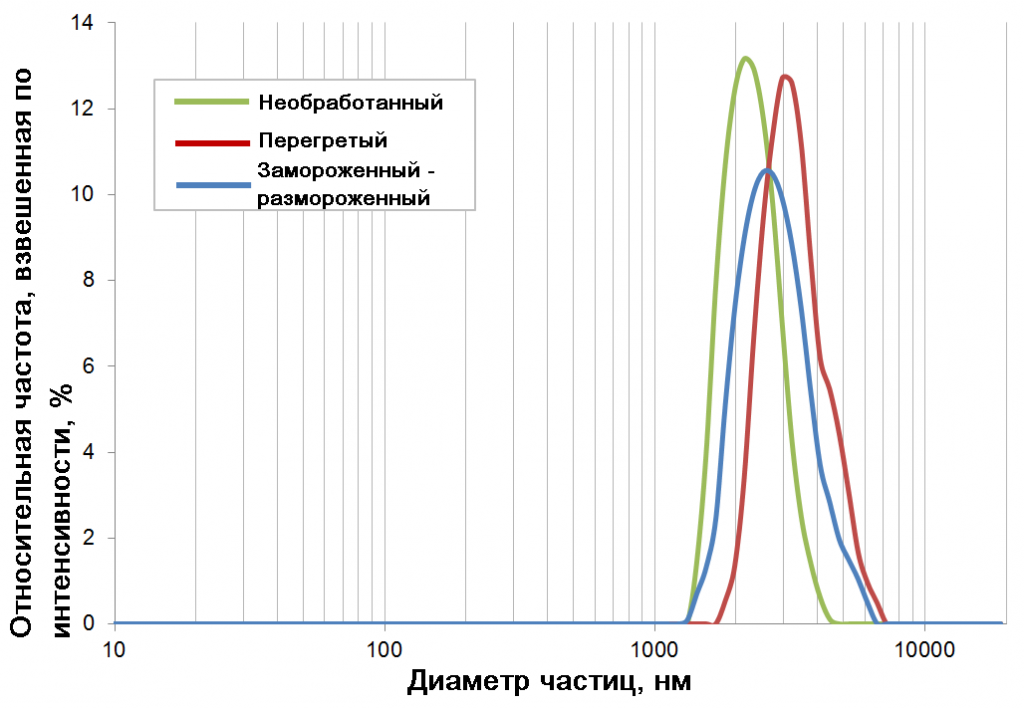
Рисунок 1. Взвешенное по интенсивности распределение частиц по размерам вакцины против КЭ, хранившейся должным образом (зеленый график), перегретой (красный график) и подвергавшейся заморозке (синий график). Кривые являются усредненными по 5-8 последовательным измерениям.
Распределение размеров частиц как замороженных, так и термообработанных образцов вакцины показывает мономодальные распределения слегка увеличенных размеров (рис. 1). Это подтверждается показателями гидродинамического диаметра (ГДД), полученными для этих образцов (Таблица 1, Рисунок 2). Действительно, среднее значение ГДД образца, подвергшегося замораживанию-оттаиванию, плавно, но значительно увеличено по сравнению с необработанным образцом, с 3030 до 3582 нм (P <0,05). Термообработанный образец демонстрирует более выраженное увеличение ГДД с 3030 до 4030 нм (P <0,01).
Таблица 1. Результаты определения гидродинамического диаметра образцов вакцины от КЭ. Показатели являются усредненными по 5-8 измерениям.
|
Параметр |
Образец | ||
|
Необработанный |
Перегретый |
Замороженный-размороженный | |
|
ГДД, нм |
3030 |
4030 |
3582 |
|
Стандартное отклонение, нм |
157 |
511 |
277 |
|
Относильное стандартное отклонение, % |
5,18 |
12,68 |
7,73 |
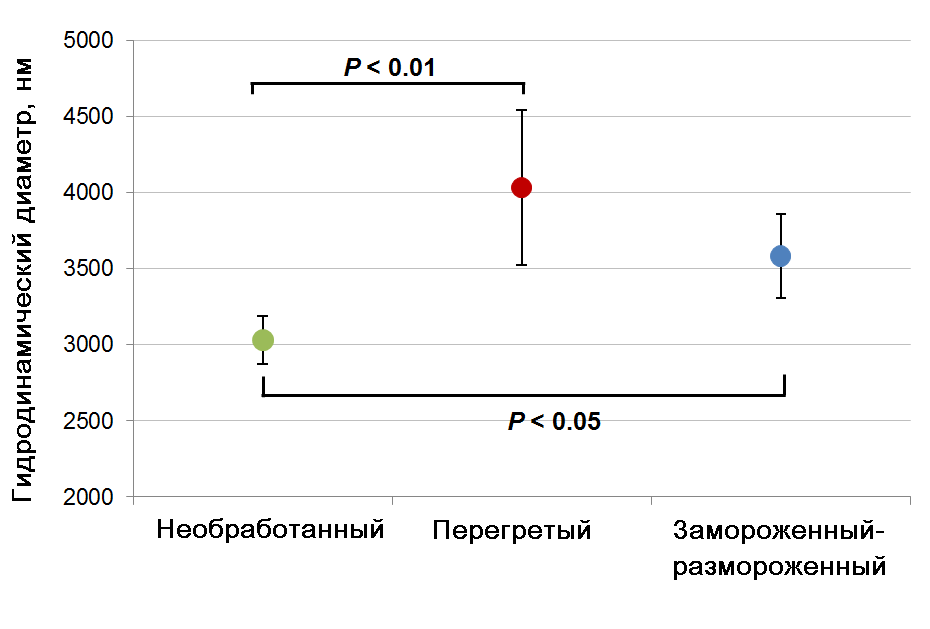
Рисунок 2. Результаты определения гидродинамического диаметра образцов вакцины от КЭ. Определенная стандартным t-тестом статистическая значимость разных наборов данных приведена в соответствующих скобках.
Следует отметить, что стандартное отклонение ГДД для термообработанного образца намного больше, чем для необработанного образца (рис. 2). Такая субоптимальная воспроизводимость предполагает, что Litesizer обнаруживает очень большие агрегаты в термообработанном образце, которые невозможно точно определить, поскольку они превышают предел обнаружения Litesizer в 10 мкм.
Совокупность данных показывает, что Litesizer способен измерять размер частиц вирусной вакцины с адъювантом соли алюминия. Обнаруженные частицы имеют ожидаемый для гидроксида алюминия размер. Интересно, что значительное увеличение ГДД наблюдается как для образцов вакцины, подвергнутых термической обработке, так и для образцов вакцины, подвергнутых замораживанию - размораживанию, что указывает на то, что серьезные нарушения холодовой цепи способствуют агрегации адъюванта.
3.2 Измерение размера частиц образцов вакцины против вируса гриппа
Ожидаемый размер живого вируса гриппа составляет около 100 нм, но было показано, что инактивация и расщепление детергента уменьшают размер первичных частиц в препаратах вакцины (6).
Гранулометрический состав образца необработанной противогриппозной вакцины показывает бимодальное распределение, при этом основной пик достигает максимума при 250 нм, а вторичный пик - около 30 нм (рис. 3, зеленая кривая). Таким образом, наши результаты показывают, что исследуемая вакцина состоит из расщепленных вирусных частиц диаметром около 30 нм и агрегатов большего размера.
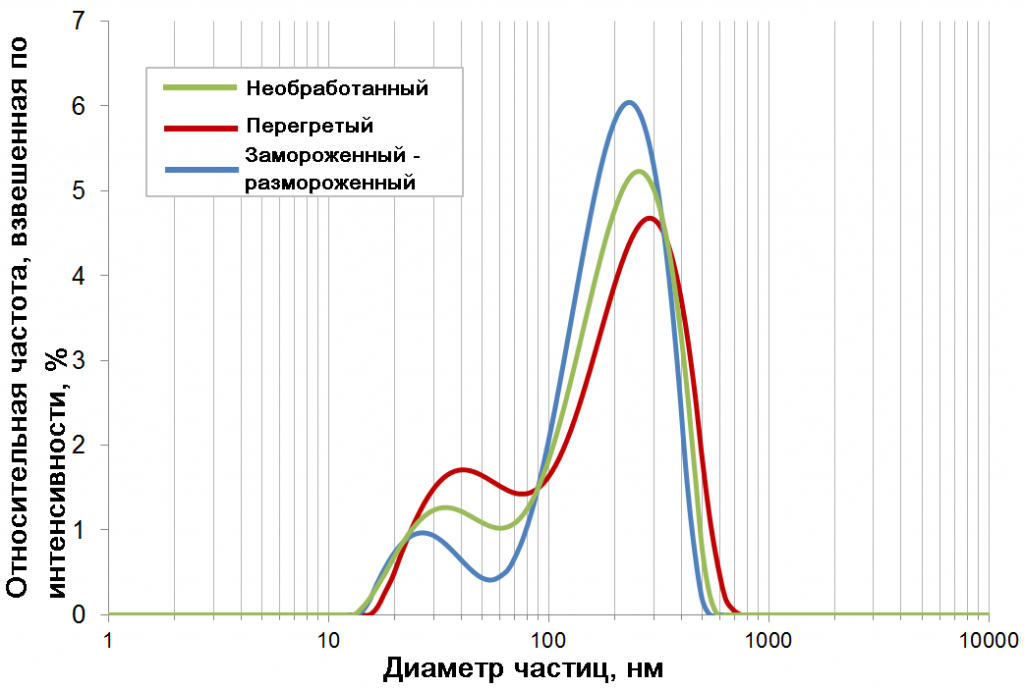
Рисунок 3. Взвешенное по интенсивности распределение частиц по размерам вакцины против вируса гриппа, хранившейся должным образом (зеленый график), перегретой (красный график) и подвергавшейся заморозке (синий график). Кривые являются усредненными по 6 последовательным измерениям.
Поскольку большие частицы вносят гораздо больший вклад в сигнал ДРС, чем более мелкие, тот факт, что крупные частицы визуально доминируют в распределении, не обязательно указывает на то, что большая часть материала находится в агрегированной форме. Фактически, когда распределение частиц по размерам пересчитывалось с взвешенного по интенсивности на объемное или числовое, пик агрегатов исчезал, а виден оставался только пик одиночных частиц (приблизительно 30 нм) (данные не показаны). Это указывает на то, что таких частиц намного больше, чем агрегатов. Однако, поскольку метод ДРС по своей природе взвешен по интенсивности, и поскольку характеристика агрегатов очень важна для контроля качества вакцин, мы выполнили анализ результатов исключительно на основе данных, взвешенных по интенсивности.
Таблица 2. Гидродинамический диаметр (в мм), пик по интенсивности (в нм) и площадь под кривой для необработанного, термообработанного и подвергнутого замораживанию-размораживанию образца вакцины против вируса гриппа.
|
Параметр |
Образец | ||
|
Необработанный |
Перегретый |
Замороженный-размороженный | |
|
ГДД ± СО*, нм |
156 ± 2,2 |
151 ± 4,4 |
164 ± 3,3 |
|
Пик 1 по интенсивности ± СО, нм |
231 ± 13,6 |
260 ± 25,5 |
218 ± 9,3 |
|
Пик 2 по интенсивности ± СО, нм |
34,2 ± 3,8 |
42,3 ± 5,4 |
29,4 ± 2,6 |
|
Площадь под кривой – Пик 1 ± СО, % |
83,7 ± 2,6 |
76,1 ± 3,9 |
89,2 ± 0,9 |
|
Площадь под кривой – Пик 2 ± СО, % |
16,3 ± 2,6 |
23,9 ± 3,9 |
10,8 ± 0,9 |
* – стандартное отклонение
Площади под кривой для пика 1 (агрегаты) и пика 2 (одиночные частицы) подтверждают различия между образцами, наблюдаемые в распределении частиц по размерам. Как показано на рисунке 4, вклад единичных частиц (пик 2) в сигнал ДРС увеличивается с 16% до 24%, когда образец подвергается термообработке (P <0,01). Напротив, единичные частицы составляют только 11% сигнала ДРС в замороженном-размороженном образце (P <0,001).
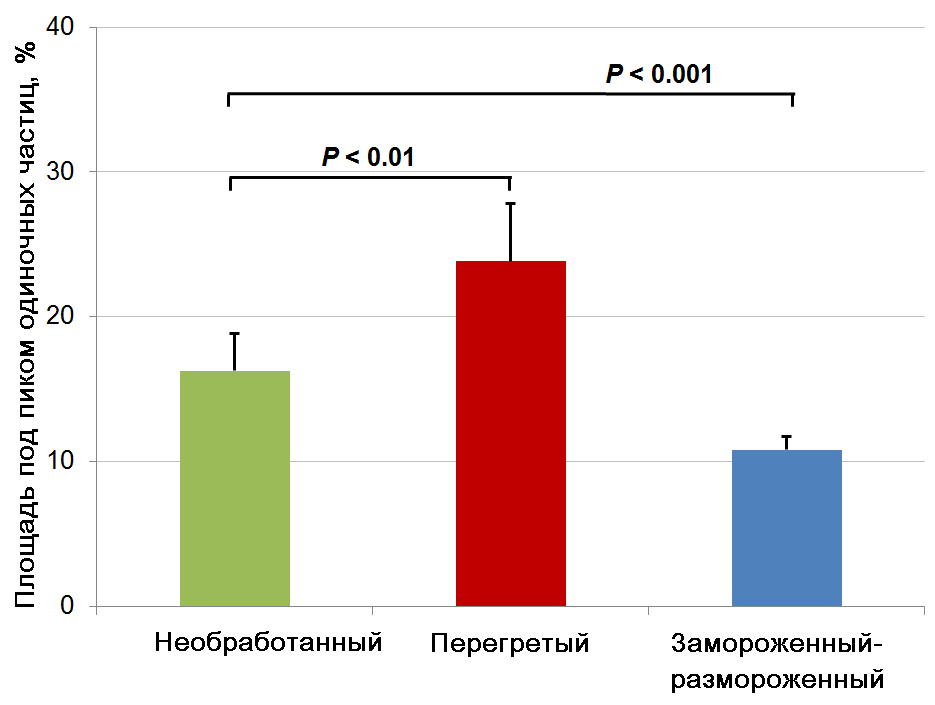
Рисунок 4. Площадь под кривой для пика 2 (единичные частицы) по интенсивности (в %) для необработанных, термообработанных и замороженных-размороженных образцов противогриппозной вакцины. Статистическая значимость между различными наборами данных, определенная стандартным t-критерием, показана в соответствующих скобках.
Эти результаты показывают, что тонкие, но существенные различия в относительной пропорции единичных частиц и агрегатов могут быть эффективно обнаружены с помощью ДРС. Наши наблюдения также предполагают, что термическая обработка и замораживание-оттаивание имеют противоположные эффекты на агрегационное поведение инактивированных частиц вируса гриппа, при этом замораживание-оттаивание способствует агрегации, в то время как термическая обработка приводит к дезагрегации.
3.3 Измерение дзета-потенциала образцов вакцины от КЭ и вируса гриппа
Поверхностный заряд частиц, характеризуемый их дзета-потенциалом, обычно используется как показатель коллоидной стабильности. Чем больше абсолютное значение дзета-потенциала, тем больше силы отталкивания между частицами и тем стабильнее будет препарат. Но в случае частиц, предназначенных для введения in vivo, также показано, что дзета-потенциал влияет на поглощение частиц конкретными клетками.
Известно, что отрицательные заряды ограничивают опсонизацию белков на экзосомах. В свою очередь это замедляет их выведение ретикуло-эндотелиальной системой и увеличивает время их жизни in vivo (7). Другие сообщения указывают на то, что катионные наночастицы преимущественно поглощаются дендритными клетками и приводят к усилению местных иммунных ответов по сравнению с их анионными аналогами (8). В целом это говорит о том, что измерение дзета-потенциала очень важно для контроля качества вакцинных препаратов.
В данной работе измерялся дзета-потенциал образцов вакцины от КЭ (необработанных, термообработанных и замороженных-размороженных) при помощи особой кюветы Univette и адаптера малого объема для нее, что позволило проводить измерения всего с 50 мкл образца.
Как показано на рисунке 5 и в таблице 3, дзета-потенциал частиц вакцины против клещевого энцефалита можно эффективно измерить с помощью Litesizer с хорошей воспроизводимостью. Средний дзета-потенциал является слабо отрицательным (около -12 мВ) и не изменяется заметно ни при термообработке, ни при замораживании-оттаивании.
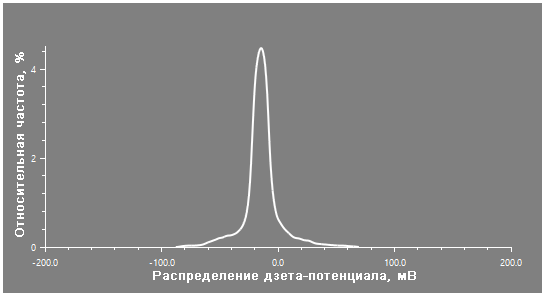
Рисунок 5. Типичное распределение дзета-потенциала для необработанного образца вакцины против клещевого энцефалита. Измерение проводилось с помощью Univette и адаптера малого объема (объем пробы = 50 мкл).
Таблица 3. Результаты измерений дзета-потенциала для необработанных, термически обработанных и замороженных-размороженных образцов вакцины против клещевого энцефалита. Средние результаты 5 последовательных измерений.
|
Параметр |
Образец | ||
|
Необработанный |
Перегретый |
Замороженный-размороженный | |
|
Средний дзета-потенциал, мВ |
-12,2 |
-11,5 |
-12,0 |
|
Стандартное отклонение, мВ |
1,3 |
0,3 |
0,2 |
|
Относительное стандартное отклонение, % |
10,6 |
2,6 |
1,4 |
Образец противогриппозной вакцины также показывает слабоотрицательные (примерно -6 мВ) значения дзета-потенциала, которые также существенно не изменяются ни после термической обработки, ни после замораживания-оттаивания (рисунок 6, таблица 4).
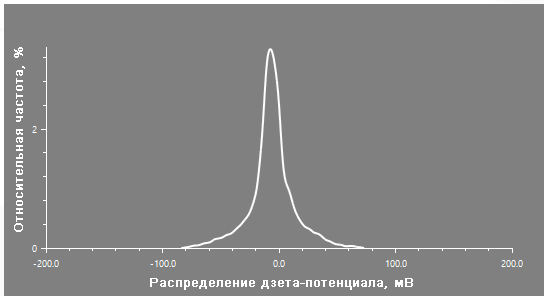
Рисунок 6. Типичное распределение дзета-потенциала для необработанного образца вакцины против гриппа. Измерение проводилось с помощью Univette и адаптера малого объема (объем пробы = 50 мкл).
Таблица 4. Результаты измерений дзета-потенциала для необработанных, термически обработанных и замороженных-размороженных образцов вакцины против клещевого энцефалита. Средние результаты 5 последовательных измерений.
|
Параметр |
Образец | ||
|
Необработанный |
Перегретый |
Замороженный-размороженный | |
|
Средний дзета-потенциал, мВ |
-6,6 |
-6,0 |
-5,7 |
|
Стандартное отклонение, мВ |
0,9 |
0,8 |
1,3 |
|
Относительное стандартное отклонение, % |
13,7 |
12,5 |
22,4 |
Как показывает практика, коллоидные системы считаются стабильными, если абсолютные значения дзета-потенциала превышают 30 мВ. Таким образом, можно предположить, что низкая величина дзета-потенциала, наблюдаемая здесь для обеих вакцин, объясняет их тенденцию к агрегации в ответ на нарушения холодовой цепи.
4 Выводы
И размер, и дзета-потенциал частиц важны для срока годности и иммуногенности вакцинных препаратов. Здесь мы демонстрируем, что Litesizer - это быстрый и эффективный прибор для характеристики противовирусных вакцин.
Вакцина против клещевого энцефалита с адъювантом соли алюминия, как и ожидалось по литературным данным, состоит из частиц нижнего микрометрового диапазона. В вакцине против гриппа, не содержащей адъюванта, наблюдаются как расщепленные вирусы, так и более крупные агрегаты. Показано, что для обеих вакцин моделируемые нарушения холодовой цепи (термическая обработка или замораживание-оттаивание) вызывают плавные, но значительные изменения в распределении частиц по размерам.
Также были успешно проведены измерения дзета-потенциала, демонстрирующие, что обе вакцины состоят из слабоанионных частиц. Нарушения холодовой цепи, по-видимому, не приводят к существенному изменению поверхностного заряда частиц вакцины.
5 Список литературы
1. Shardlow E., Mold M. & Exley C. (2017). From stock bottle to vaccine: elucidating the particle size distributions of aluminum adjuvants using dynamic light scattering. Frontiers in Chemistry 4:48.
2. Etchart N., et al. (2001). Dendritic cells recruitment and in vivo priming of CD8+ CTL induced by a single topical or transepithelial immunization via the buccal mucosa with measles virus nucleoprotein. Journal of Immunology 167:384-391.
3. Slütter B. & Jiskoot W. (2016). Sizing the optimal dimensions of a vaccine delivery: a particulate matter. Expert Opinion on Drug Delivery 13:167-170.
4. World Health Organization (WHO) (2011). Vaccines against tick-borne encephalitis: WHO position paper. Weekly Epidemiological Record 86:241-256.
5. Lamb Y.N. (2019). Cell-Based Quadrivalent Inactivated Infuenza Virus Vaccine (Flucelvax® Tetra/Flucelvax Quadrivalent®): A Review in the Prevention of Influenza. Drugs . 2019, Bd. 79, S. 1337–1348.
6. Kon T.C., et al. (2016). Influenza Vaccine Manufacturing: Effect of Inactivation, Splitting and Site of Manufacturing. Comparison of Influenza Vaccine Production Processes. PLOS One 11:e0150700.
7. Ren J., He W., Zheng L. & Duan H. (2016). From structures to functions: insights into exosomes as promising drug delivery vehicles. Biomaterials sciences 4:910-921.
8. Fromen C.A., et al. (2016). Nanoparticle surface charge impacts distribution, uptake and lymph node trafficking by pulmonary antigen-presenting cells. Nanomedicine 12:677–687.
Измерения и оригинальный текст
Nathalie Etchart
Контакты
Anton Paar GmbH
Эксклюзивный дилер в России:
ООО "АВРОРА"
+7(495)-258-83-05/-06/-07


