Определение концентрации путем измерения плотности гипохлорита натрия - дезинфицирующего средства для питьевой воды и бассейнов, используемого для санитарной обработки помещений и объектов, - позволяет избежать неэффективной дезинфекции и судебных разбирательств с поставщиками.
1. Вступление
Очистка питьевой водыВсемирная организация здравоохранения (ВОЗ) уже много лет занимается медицинскими аспектами управления водными ресурсами и публикует различные документы, касающиеся безопасности водной среды и ее значения для здоровья.
Посыл ясен: Все запасы воды должны быть обеззаражены [1].
Это обеспечивает растущий спрос на дезинфицирующие средства.
В настоящее время основным дезинфицирующим средством, используемым во всем мире, является хлор, хотя альтернативы ему все чаще исследуются и такие процессы, как озонирование, становятся все более распространенными.
Хлор, как правило, является предпочтительным дезинфицирующим средством, поскольку он достаточно эффективен, дешев и прост в обращении. Во всех водоочистных сооружениях, кроме самых маленьких, хлор добавляют в воду либо в виде водного раствора (обычно гипохлорит натрия, NaOCl), либо в виде газообразного хлора. Рекомендуемая концентрация NaOCl в воде может варьироваться от 0,5 мг/л до 2,0 мг/л.
Другие дезинфицирующие средства включают озон, ультрафиолетовый свет и йод. Все это имеет свои недостатки. УФ-излучение не является особенно эффективным дезинфицирующим средством, и трудно подвергать воду воздействию в течение достаточного времени для того, чтобы дезинфекция была эффективной. Ни озон, ни УФ-излучение не обеспечивают остаточного дезинфицирующего средства и, следовательно, не обеспечивают защиты от повторного загрязнения при распределении. И йод, и озон канцерогенны. Существуют также серьезные проблемы для здоровья и безопасности операторов, связанные с образованием и применением озона и хлора (особенно в газообразной форме). Йод также может привести к проблемам со щитовидной железой у беременных женщин и, как правило, более токсичен, чем хлор.
Борьба с вирусами и бактериями в воде плавательного бассейна обычно осуществляется путем соответствующей обработки, включающей фильтрацию и применение хлора или других дезинфицирующих средств.
Наиболее часто используемые химические дезинфицирующие средства содержат хлор в виде газа и гипохлорита [2]. Рекомендуемая концентрация NaOCl в воде может варьироваться в диапазоне от 1,0 мг/л до 4,0 мг/л в зависимости от правил страны.
Санитарная обработка помещений/объектов
Дезинфицирующее средство, содержащее NaOCl, рекомендовано рядом учреждений, включая ВОЗ и Центры по контролю и профилактике заболеваний США (CDC), в качестве дешевого, но эффективного дезинфицирующего средства для помещений и объектов, зараженных бактериями и вирусами [3]. NaOCl требуется от 5 до 10 минут времени контакта для инактивации микроорганизмов.
В свете пандемии коронавируса правительства различных штатов Индии, например, проводили дезинфекцию улиц растворами, содержащими гипохлорит натрия [4].
Общемировая рекомендуемая (ВОЗ) концентрация растворов NaOCl в воде для санитарной обработки составляет 0,1 %..
2. Гипохлорит натрия, NaOCl
Основная информация
Гипохлорит натрия (NaOCl) - эффективное, дешевое и простое в обращении дезинфицирующее средство.
Это соединение представляет собой водный раствор, содержащий от 1 до 18 % “активного хлора”, который является дезинфицирующим средством, альгицидом, фунгицидом и микробицидом.
Раствор необходимо бережно хранить, чтобы предотвратить ухудшение качества, помимо этого он может вызвать ожоги при контакте с кожей.
NaOCl рекомендован во всем мире (ВОЗ) и разрешен (включая Европейский союз и EPA США) в качестве дезинфицирующего средства для питьевой воды, плавательных бассейнов и дезинфекции помещений/объектов.
США: Согласно списку регулируемых веществ FDA 40 CFR §68.130, гипохлорит натрия не является регулируемым веществом, поэтому проверка концентрации “активного хлора” не требуется [5], если соблюдаются рекомендуемые разбавления.
ЕС: Европейский союз имеет Директиву ЕС № 1451/2007 в области питьевой воды [6], которая установила минимальные стандарты качества воды, предназначенной для потребления человеком. Директива включает ограничения на дезинфицирующие средства и побочные продукты дезинфекции, аналогичные тем, которые рекомендованы ВОЗ. Как и в случае с американским законодательством, гипохлорит натрия не нуждается в проверках “активного хлора".
Приготовление NaOCl
NaOCl - это продукт хлорирования соды, NaOH, в соответствии со следующей реакцией:
Cl2 + 2 NaOH → NaCl + NaClO + H2O (1)
Процесс Хукера является единственным промышленным методом получения гипохлорита натрия. При этом гипохлорит натрия (NaClO) и хлорид натрия (NaCl) образуются при пропускании газообразного хлора через холодный разбавленный раствор гидроксида натрия. Температура раствора должна быть ниже 40 °C (с помощью охлаждающих змеевиков), чтобы предотвратить нежелательное образование хлората натрия [7].
Химические реакции, стоящие за дезинфекцией
Гипохлорит натрия диссоциирует в воде (уравнение 2), а его ион OCl - гидролизуется до хлорной кислоты (HClO) в соответствии с уравнением (3):
NaOCl → Na+ + OCl- (2)
OCl-+ H2O ↔ HClO + OH- (3)
Растворы NaOCl достаточно щелочные, рН 11 или выше, так как хлорноватистая кислота является слабой кислотой. Обычно для того, чтобы снизить значение рН до оптимального значения (~7) в момент использования добавляют раствор соляной кислоты.
Хлорноватистая кислота участвует в следующем равновесии с хлором (Cl2):
HClO + H3O+ + Cl- ↔ Cl2 + 2H2O
Соотношение Cl2/HClO/ClO - зависит от рН и температуры. HClO преобладает в диапазоне рН от 2 до 7 [8].
Недиссоциированная хлорноватистая кислота (HClO) действует как дезинфицирующее средство.
Неправильное использование NaOCl, включая отклонение от рекомендаций разбавления (более сильные или более слабые концентрации), может снизить его эффективность для дезинфекции и привести к травмам.
Доступный хлор (Cl2)
До разработки растворов гипохлорита натрия хлор использовался непосредственно для дезинфекции, отбеливания и окисления. Благодаря преимуществам хранения водных растворов гипохлорита натрия хлор был заменён во многих областях применений [8].
Чтобы понять, сколько хлора (Cl2) находится в растворе гипохлорита натрия (NaOCl), рассмотрим уравнения (4) и (5).
NaOCl+ 2KI + 2HAc → I2+ NaCl + 2KAc + H2O (4)
Cl2 + 2KI → I2 + 2KCl (5)
Моль гипохлорита натрия окисляет такое же количество йодида, как и моль хлора. Учитывая, что молекулярная масса NaOCl составляет 74,5 г/моль, а хлора (Cl2) - 71 г/моль, “доступный хлор” можно рассчитать как отношение 74,5/71=1,05.
Стандартные единицы концентрации раствора гипохлорита натрия [9]:• “% гипохлорита натрия” (масс./масс.)
• “% активного хлора” (масс./об.)
• “г/л активного хлора” (грамм активного хлора/литр раствора гипохлорита натрия)
При переходе от концентрации масс./масс. к концентрации масс./об. необходимо учитывать плотность.
Титрование - это метод определения концентрации NaOCl (и, следовательно, % активного хлора). Метод медленный, сложный и требует квалифицированного персонала.
В случае свежих образцов мы рекомендуем измерение плотности для определения концентрации NaOCl, которое является быстрым, точным и не требует квалифицированного персонала.
Ухудшение качества NaOCl
К сожалению, концентрация NaOCl изменяется во время хранения из-за процесса старения/ухудшения качества в соответствии с уравнением (6):
3 NaOCl (водн.) → 2 NaCl (водн.) + NaClO3 (водн.) (6)
Снижение качества зависит от температуры [10].
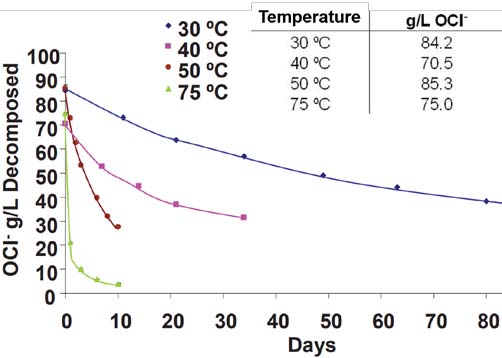
Рис. 2: Разложение NaOCl при различных температурах
Важность плотности/удельного веса
Плотность - это удобный аналитический инструмент, используемый в химической промышленности для быстрой идентификации соединений и корреляции качества продукции без проведения трудоемких тестов “мокрой химии”.
• Измерения плотности позволяют количественно определить концентрацию NaOCl до и после разведения, облегчая работу техников.
• Плотность может быть непосредственно использована как параметр качества: клиент проверяет только соответствие плотности значению на этикетке.
• Плотность-необходимый параметр для преобразования объем/масса
Кроме того, поставщики питьевой воды покупают несколько химических веществ, таких как соляная кислота (HCl) и серная кислота (H2SO4), для работы заводов. Концентрации всех этих химических веществ можно легко определить с помощью измерений плотности.
3. Определение концентрации NaOCl
Как уже упоминалось ранее, неправильное использование NaOCl влияет на эффективность дезинфицирующего средства или может вызывать раздражения кожи.Концентрацию NaOCl следует проверять во время поставки, чтобы избежать ошибок в процессе дезинфекции и судебных разбирательств с поставщиками.
Классическим методом анализа, используемым для определения концентрации NaOCl, является титрование.
Сам процесс титрования вместе с очисткой приборов требует много времени, зависит от человеческого фактора и нуждается в квалифицированном персонале.
Целесообразно определение концентрации с помощью цифрового плотномера.
Определение плотности NaOCl [12] позволяет определить его концентрацию и рассчитать % активного хлора для свежих образцов, как показано в таблице 1.
| Плотность | % NaOCl | % Активного хлора | Активный хлор |
|---|---|---|---|
| г/см3 | масс./масс | масс./масс. | г/л |
| 1.014 | 1.05 | 1.0 | 10.14 |
|
1.043 |
3.15 | 3.0 | 31.29 |
| 1.082 | 5.78 | 5.5 | 59.51 |
| 1.159 | 10.50 | 10.0 | 115.90 |
| 1.218 | 13.97 | 13.3 | 161.99 |
| 1.225 | 14.28 | 13.6 | 166.60 |
4. DMA 35 для измерения плотности
DMA 35Плотность и температура измеряются одновременно, и прибор автоматически выполняет температурную коррекцию.
2 мл образца заливаются в прибор простым нажатием и отпусканием кнопки насоса. В течение нескольких секунд результат будет отображен на цифровом дисплее и сохранен в памяти прибора.
Благодаря автоматической коррекции температуры быстро можно получать сопоставимые результаты, например, при температуре 20 °C, независимо от фактической температуры ячейки. Для получения достоверных результатов измерений температура образца должна находиться в диапазоне от 0 °C до 40 °C. После измерения DMA 35 можно легко очистить дистиллированной водой.

Рис. 3: Портативный плотномер DMA 35
Традиционный метод измерения плотности, пикнометрия, требует квалифицированных операторов, большого количества образца и чистящих средств, длительного времени анализа, очистки и нуждается в ручной коррекции температуры.
5. Заключение
DMA 35 - это идеальное решение для проверки концентрации NaOCl в процессе очистки воды за несколько секунд, избегая сложного и медленного аналитического метода, такого как титрование, которое требует квалифицированного персонала.
Проверка концентрации NaOCl позволяет избежать таких ошибок, как неправильная маркировка и судебные разбирательства с поставщиками. Кроме того, DMA 35 подходит для определения концентрация растворов во время процесса разбавления.
Прибор портативен, прост в обращении (обучение не требуется) и минимизирует действие химических веществ на персонал во время измерений.
6. Литературные источники
[1]https://www.who.int/water_sanitation_health/dwq/S13.pdf[2]https://www.who.int/water_sanitation_health/bathing/srwe2full.pdf
[3] https://www.who.int/ihr/publications/Annex7.pdf
[4]https://www.businessinsider.in/india/news/heres-how-sodium-hypochlorite-is-being-sprayed-on-the-stre...
[5]https://www.epa.gov/rmp/amounts-chlorine-present-sodium-hypochlorite
[6]https://eur-ex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2007:325:0003:0065:EN:PDF
[7] Vogt H, Balej J, Bennett JE, Wintzer P, Sheikh SA, Gallone P (2007). "Chlorine Oxides and Chlorine Oxygen Acids". Ullmann's Encyclopedia of Industrial Chemistry (7th ed.). Wiley. p. 2
[8]https://echa.europa.eu/documents/10162/24380810/7494_1391-01_Assessment_Report.pdf/0f87765c-1bb2-9bb...
[9]https://www.oxy.com/OurBusinesses/Chemicals/Products/Documents/sodiumhypochlorite/bleach.pdf
[10]Hypochlorite ion decomposition, L.C Adam, G. Gordon Inorg. Chem. 1999, 38, 6, 1299–1304
[11]IOSR Journal of Applied Chemistry 7(1):19-23 January 2014
[12]http://www.sciencemadness.org/talk/files.php?pid=391303&aid=37353